
2023年12月1日,苏州大学程亮教授团队、张克勤教授团队以及苏州大学附属第二医院周晓中主任团队共同合作,在Cell Press细胞出版社旗下期刊Matter上发表了最新研究成果,题为“Self-assembled silk fibroin injectable hydrogels based on layered double hydroxides for spinal cord injury repair”。该研究报道了一种新型蚕丝蛋白基多功能生物活性水凝胶协同促进脊髓损伤后神经组织修复和再生的研究工作。该研究采用超薄MgMn-LDHs水滑石抗氧化纳米材料与蚕丝蛋白通过氢键诱导蚕丝蛋白形成β-sheet结构,从而促进水凝胶的形成。该水凝胶表现出优异的协同治疗效果,如改善氧化应激及乏氧微环境、减轻炎症、以及调节细胞内金属离子浓度,以促进神经元的生长和分化等,并显著改善脊髓损伤小鼠的运动功能。研究结果拓展了新型蚕丝蛋白生物活性水凝胶材料在脊髓损伤修复中的应用。

脊髓损伤具有较高的发病率和致残率,是最严重的公共卫生问题之一。在脊髓损伤的过程中,初级创伤会引发强烈的炎症反应并产生大量的活性氧(ROS),对中心及周围神经组织持续造成严重的损害。为此,研究人员致力于开发基于抗氧化剂的治疗策略,旨在清除活性氧并缓解炎症。然而,这些策略一直未能取得理想的治疗效果,主要原因是中枢神经系统的自发再生能力有限,包括有限的轴突再生和髓鞘再生。
脊髓损伤患者常常表现为镁离子(Mg2+)缺乏,继而导致P物质(一种速激蛋白)的释放。这种物质最终会引发神经细胞水肿,甚至死亡。相反,适当的补充Mg2+可以有效促进神经修复并防止中枢神经系统损伤后的细胞死亡。此外,由于受损的血管阻碍了向脊髓损伤部位的氧气输送,继而造成的乏氧环境也对神经再生造成了极大的限制。将活性氧等有害的物质转化为有益的氧气为脊髓损伤治疗提供了一条有前景的途径。值得注意的是,一些生物活性金属离子,如锰离子能够在不同价态之间进行电子转移,因而表现出优异的抗氧化性能,可以持续清除活性氧。特别是三价锰离子(Mn3+)可以催化一些活性氧,如过氧化氢、超氧根阴离子等生成氧气。因此,基于Mg2+/Mn3+的生物活性材料在协同促进神经组织修复和再生方面具有很大的前景。
基于上述思路,苏州大学程亮教授团队、张克勤教授团队和苏大附二院周晓中教授团队设计构建了一种基于生物活性功能纳米材料的可注射水凝胶。超薄的MgMn-LDHs纳米片层与蚕丝蛋白以氢键相互作用的方式结合,通过诱导蚕丝蛋白β-sheet结构自组装形成一种新型的可注射水凝胶。该水凝胶以Mn3+为活性位点持续清除ROS并产生氧气,缓解了脊髓损伤氧化应激和乏氧的微环境。更重要的是,水凝胶缓慢释放出Mg2+,进而调节细胞内Mg2+浓度以激活分化途径促进了神经元的生长和分化,实现了对神经的修复再生。此外,该功能水凝胶有效诱导抗炎巨噬细胞的激活,从而减轻炎症反应。这种协同治疗的综合效果,包括抑制炎症、改善乏氧和调节细胞内金属离子浓度共同促进神经生长和再生,显著改善脊髓损伤小鼠的运动功能。
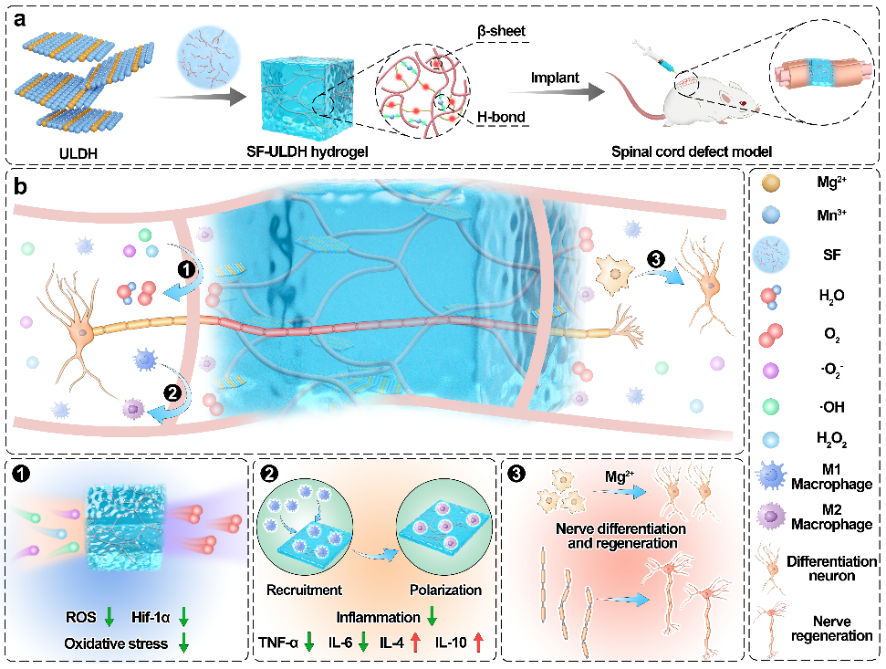
图1. 水凝胶的制备及其在脊髓损伤修复中的作用机制示意图
超薄MgMn-LDHs的构建及其抗氧化、产氧性能
研究团队首先通过水热法和液相剥离法合成了超薄的MgMn-LDHs(ULDH)纳米片层材料,并通过透射电镜、X-射线粉末衍射、X-射线光电子能谱、原子力显微镜等对其形貌、晶型、离子价态、片层厚度等进行了表征分析(图2)。结果表明成功合成了超薄片层的MgMn-LDHs水滑石纳米材料,其片层厚度约为4 nm,片层平均直径约为50 nm。
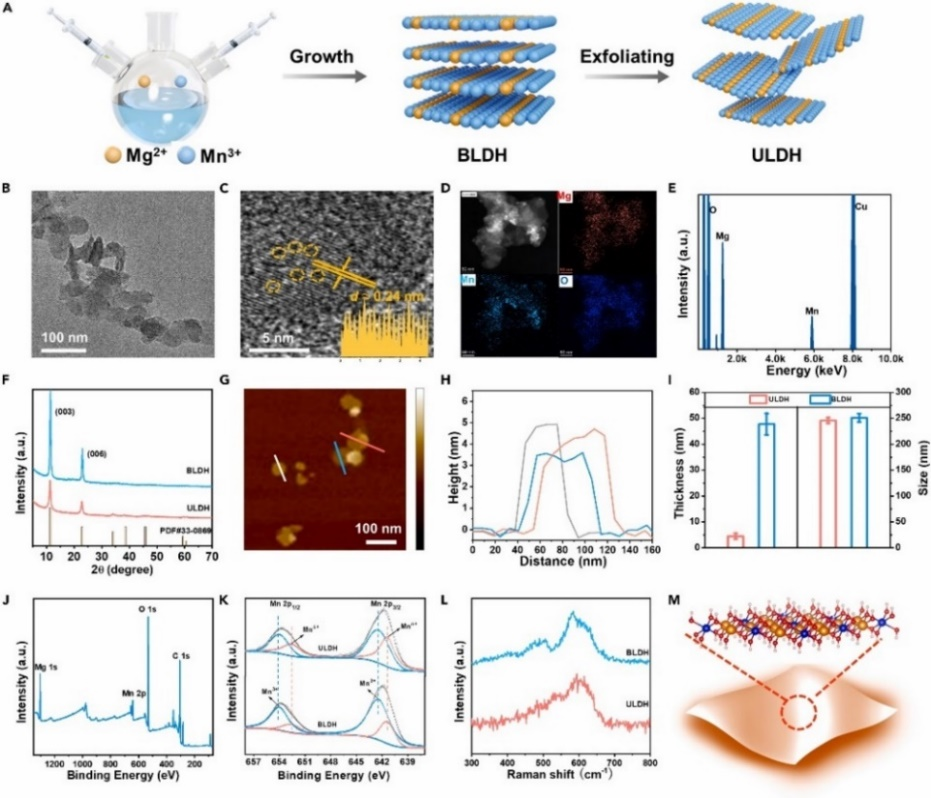
图2. 超薄MgMn-LDHs的合成与表征
接着,研究了合成的ULDH对活性氧的清除效果。紫外吸收光谱显示在较低的浓度范围内,ULDH表现出优异的活性氧清除效果。特别是,在清除过氧化氢以及超氧根阴离子等活性氧自由基时,还伴随着大量氧气的生成。通过X-射线粉末衍射和拉曼光谱对ULDH与过氧化氢反应前后进行了表征。结果显示,在与过氧化氢反应后,有Mn4+-O键的生成,证明ULDH优异的抗氧化和产氧性能源于不同Mn离子价态之间的转变(图3)。
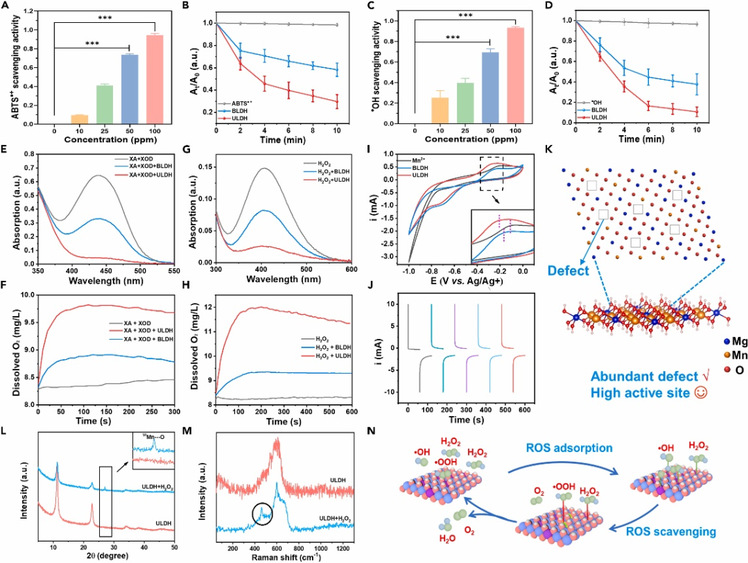
图3. ULDH清除ROS和生成O2的性能和机制
水凝胶的形成机理及其流变行为
丝素蛋白(SF)因其来源充足,且具有优异的生物相容性和可调的生物降解性,使其在生物医学领域具有广阔的应用前景。研究团队利用LDHs表面的羟基与蚕丝蛋白分子形成的氢键相互作用诱导蚕丝蛋白形成-sheet结构,构建了一种新型水凝胶(SF-ULDH)。傅里叶变换红外光谱、X-射线衍射等表征均证明ULDH有效促进了β-sheet及β-结晶结构形成(图4),最终有助于建立稳定的水凝胶网络结构。流变结果显示该水凝胶具有良好的剪切变稀以及自修复性能。
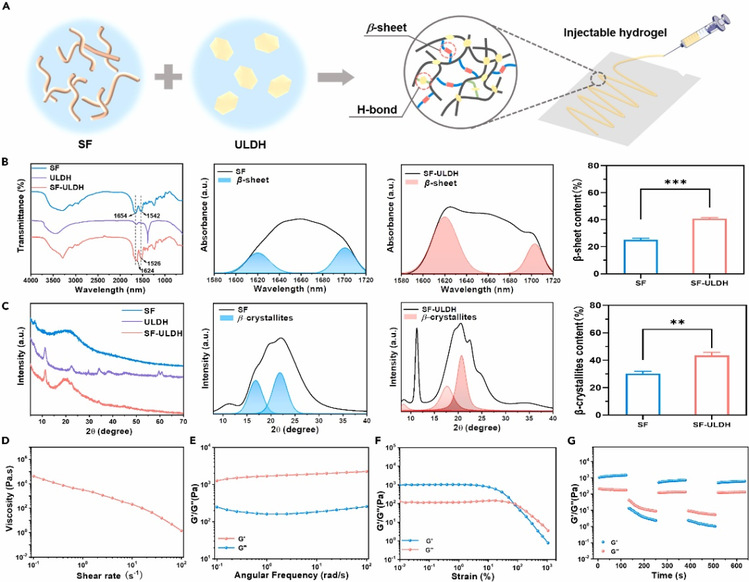
图4. 水凝胶的合成与表征
功能水凝胶促神经修复机制研究
研究团队进一步通过RNA转录组测序研究了水凝胶促神经细胞生长分化的机制(图5)。在H2O2处理的低氧环境下,SF-ULDH水凝胶处理的细胞展现出大量显著差异调控的基因,与低氧应答相关以及凋亡相关的关键基因均显著下调。这些基因表达变化与SF-ULDH水凝胶改善的低氧条件和ROS水平的降低密切相关。GO与KEGG分析均显示,水凝胶显著改善了细胞分化,神经元保护、生长因子活性等方面,以及通过激活包括P13K-Akt等多条信号通路促进受损的神经细胞生长和分化。
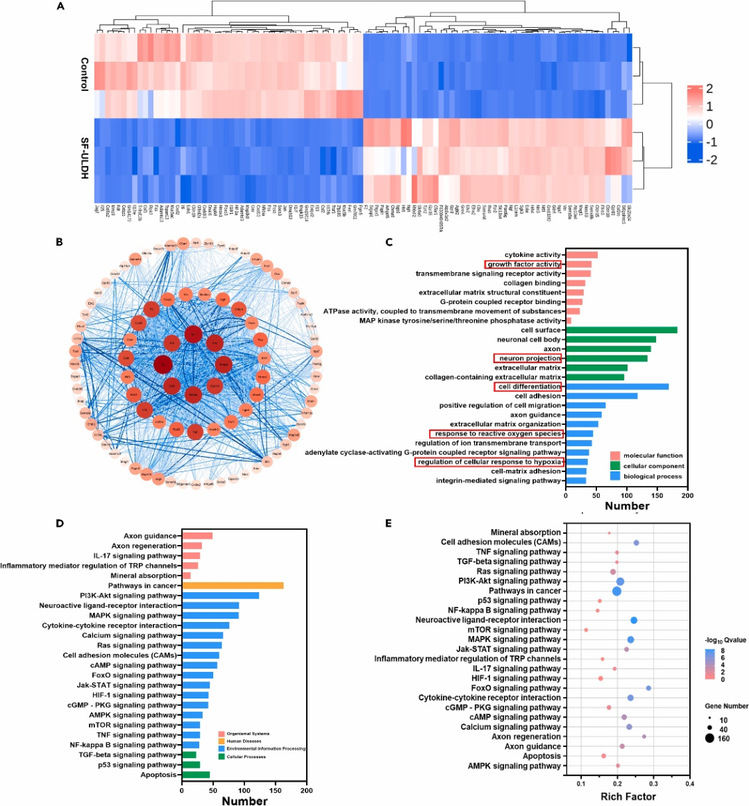
图5. RNA转录组测序
功能水凝胶对脊髓损伤小鼠修复效果
研究团队进一步评估了水凝胶在脊髓损伤小鼠的治疗效果(图6)。将水凝胶注射至脊髓损伤部位直至腔内完全填充。在10周后,注射SF-ULDH组小鼠表现出有效的运动功能恢复。Basso Mouse Scale (BMS)测试结果显示SF-ULDH组的平均BMS评分稳步上升。免疫荧光及Western blot结果显示,水凝胶可有效促进神经元的生长和再生,促进神经生长因子的分泌,抑制小胶质、瘢痕组织的形成。这些动物实验结果表明,SF-ULDH功能水凝胶可以有效地促进组织再生、神经元修复分化以及运动功能恢复。
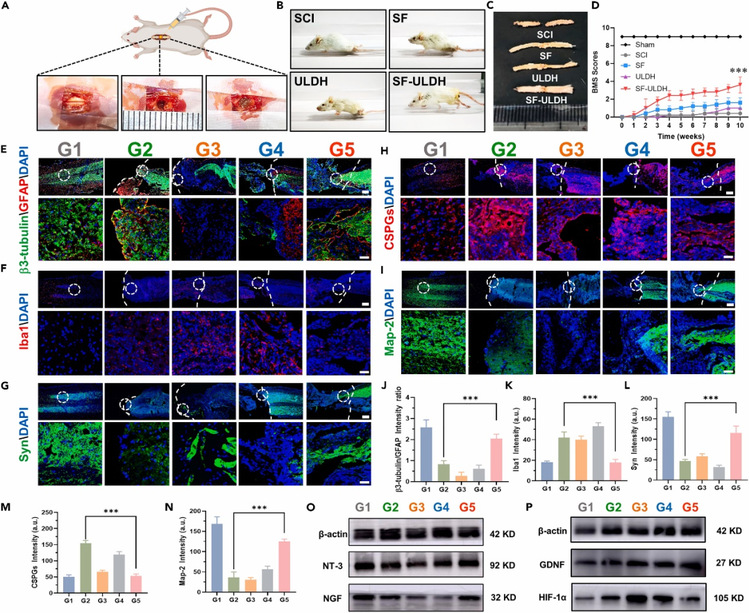
图6. 体内脊髓损伤修复情况评价
最后,研究团队进一步在动物水平上研究了功能水凝胶对神经炎症的影响(图7)。免疫荧光、流式分析及蛋白印迹测试结果表明,SF-ULDH水凝胶可有效清除损伤部位的ROS,并通过促进O2生成有效缓解乏氧。炎症反应评估结果表明:SF-ULDH水凝胶注射2周后显著降低了SCI损伤组织CD86+炎症细胞数量,增加了CD206+细胞的表达量;同时,SF-ULDH组表现出促炎因子(如IL-6和TNF-α)水平明显低于对照组,而抑炎因子(如IL-4和IL-10)分泌明显增加。因此SF-ULDH功能水凝胶改善了病灶部位的乏氧情况,降低了ROS水平,从而减轻了炎症。
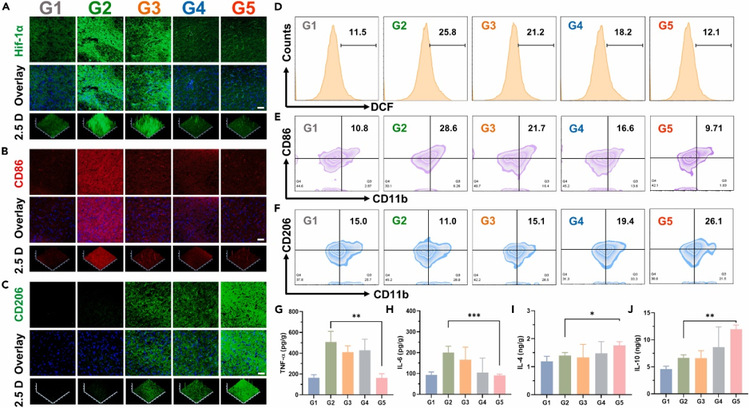
图7. 体内脊髓损伤后炎症评价
总结与展望
脊髓损伤由于病理微环境中镁离子稳态失衡、乏氧、炎症和活性氧物质的升高而阻碍神经再生。研究团队开发了一种基于蚕丝蛋白的生物活性功能可注射水凝胶,通过将超薄抗氧化的MgMn-LDHs与蚕丝蛋白相结合,促进了蚕丝蛋白β-sheet结构的形成。SF-ULDH水凝胶持续清除ROS并产生氧气,以缓解氧化应激和乏氧的病理微环境。与此同时,SF-ULDH功能水凝胶缓慢释放的Mg2+,调节细胞中的离子浓度,激活促神经生长通路,实现了有效促进神经细胞的生长和分化。该项研究阐明了蚕丝蛋白基生物活性功能水凝胶材料在脊髓损伤中的修复机理并拓展了其应用。
▌论文标题:
Self-assembled silk fibroin injectable hydrogels based on layered double hydroxides for spinal cord injury repair
▌论文网址:
https://www.cell.com/matter/fulltext/S2590-2385(23)00569-6
▌DOI:
https://doi.org/10.1016/j.matt.2023.11.006
